
Neuroscienze
1. Neuro-Balance Profile
Pannello diagnostico completo per l’analisi dei metaboliti psicoattivi, parametri che sono stati collegati a disturbi psicologici o comportamentali.
I nostri test rappresentano una nuova soluzione per la diagnosi e il controllo della terapia di una serie di malattie come:
- Depressione, ansia
- Stress, esaurimento, disagio
- Sbalzi d’umore, nervosismo
- Problemi comportamentali, disturbi dell’attenzione
- Insonnia
- Disturbi alimentari
- Disturbi neurologici

La gamma:
BCAA (colorimetric assay) Cat. No. IMM-K7016
GABA (ELISA) Cat. No. IMM-KR7012
IDK® IDO (Indoleamine 2,3-dioxygenase 1) (ELISA) Cat. No. IMM-KR7727
IDK® IDO activity (ELISA) Cat. No. IMM-K7726
IDK® Kynurenine (ELISA) Cat. No. IMM-K7728
IDK® Serotonin (ELISA) Cat. No. IMM-K6880
IDK® Tryptophan (ELISA) Cat. No. IMM-K7730
Tyrosine (ELISA) Cat. No. IMM-KR7015 (for research use only)
Ora disponibili kit ELISA per l’analisi di alcuni di questi analiti su campioni di feci:
IMM-K6881 Serotonin (stool) ELISA CE/IVD
IMM-K7009 GABA (stool) ELISA CE/IVD
IMM-K7729 Tryptophane (stool) ELISA CE/IVD
2. Alzheimer
| Anticorpi Agrisera Oligomer-specific amyloid-beta (mouse): |
- Anticorpo monoclonale sviluppato in mouse
- Isotipo IgG
- Si legano agli oligomeri beta-amiloide ma non afibrille (Fig. 1)
.

IAPP | Human IAPP (amylin) 1-37, specific to disulphide-bridge between Cys2-Cys7 AGR-AS08359
mAB-M | Mouse anti-human Abeta protein (3-10) region, oligomer-specific (clone 2D10.F6) AGR-AS132716
mAB-O | Mouse anti-human Abeta protein (3-10) region, oligomer-specific (clone 3E5.F8) AGR-AS132715
ELISA kit:
Anticorpi 4BioDx anti-phospho APP e anti-phospho Tau con caratteristiche uniche come biomarcatori nelle malattie neurodegenerative:
- 4BDX-1501 Anti-Tau [pS422] (clone 2H9) 100 µg
- 4BDX-1501s Anti-Tau [pS422] (clone 2H9) 20 µg
- 4BDX-1502 Anti-Tau [pS199] 80 µg
- 4BDX-1502s Anti-Tau [pS199] 40 µg
- 4BDX-1503 Anti-APP [pT668] 80 µg
- 4BDX-1503s Anti-APP [pT668] 40 µg
Anti-phospo TAU
L’anticorpo monoclonale 4BDX-1501 anti-Tau [pS422](clone 2H9) è un biomarker UNICO e specifico della degenerazione neurofibrillare per le seguenti caratteritiche:
- prodotto in mouse
- validato per western blot, immunoistochimica e immunofluorescenza
- validato per gli studi di immunoterapia sui topi
- funziona su tessuti umani, di topo e di ratto

Le proteine Tau regolano la polimerizzazione e la stabilità dei microtubuli attraverso i domini di fosforilazione.
Nella malattia di Alzheimer e disturbi correlati, queste proteine tau si aggregano in filamenti. Le proteine Tau di questi filamenti sono fosforilate.
Molti siti di fosforilazione si trovano anche in condizioni fisiologiche. Tuttavia, il fosfo-Ser422 è considerato come un sito anormale di fosforilazione e si trova in diverse malattie con degenerazione neurofibrillare (Bussière et al., 1999). La fosfo-Ser422 è correlata con la gravità della patologia neuronale nella malattia di Alzheimer (Augustinack et al., 2002) ed è anche un epitopo riscontrato in numerosi modelli di topo transgenico Tau. Con tali caratteristiche, questo epitopo è stato anche considerato in molti approcci immunoterapici (Troquier et al., 2012, Collin et al., 2014).
L’anticorpo monoclonale clone 2H9 (Rif. 4BDX-1501) è diretto contro fosfo-Ser422 e non cross-reagisce con il peptide Ser422 non fosforilato (mediante ELISA). Questo anticorpo è utilizzato in immunoblotting per rilevare l’epitopo pS422 negli omogenati del cervello da pazienti che presentano una tauopatia. Con l’immunoistochimica, questo riferimento è stato indicato per rilevare i grovigli neurofibrillari (neurofibrillary tangles) nei pazienti con malattia di Alzheimer e sezioni di cervello transgenico Tau. L’anticorpo monoclonale è adatto anche per l’immunoterapia in modelli sperimentali di Tauopatie. Questo specifico biomarcatore (Rif. 4BDX-1501) di degenerazione neurofibrillare è in realtà l’unico anticorpo monoclonale murino commercialmente disponibile.
L’epitopo patologico della serina fosforilata 422 di Tau si trova nella malattia di Alzheimer, nella demenza da granuli argirofili (Tolnay et al., 2002) ma anche in molte altre tauopatie tra cui sindrome di Down, degenerazione corticobasale, paralisi sopranucleare progressiva, malattia di Pick e demenza frontotemporale alla mutazione del gene MAPT (Bussière et al., 1999; Sergeant et al., 1999).
L’epitopo fosfo-serina 422 è anche osservato negli aggregati tau nella miosite di corpi inclusi (Maurage et al., 2004). Recentemente è stato dimostrato che la fosforilazione di tau a serina 422 protegge tau dalla scissione della caspasi (Sandhu et al., 2017).
Nella malattia di Alzheimer, tau fosforilato a serina 422 si trova nei neuroni pre-tangle (Guillozet-Bongaarts et al., 2016), e la rilevazione di serina fosforilata 422 tau è correlata con la malattia neuropatologia e declino cognitivo (Vana et al., 2011).
In parallelo, l’anticorpo Anti-Tau [pS199] (Rif. 4BDX-1502) rileva in modo specifico iperfosforilazione di Tau alla serina 199 nei primi stadi della degenerazione neurofibrillare nel tessuto cerebrale umano o in modelli animali di tauopatie.
Chiaramente, la fosforilazione della proteina Tau alla serina 199 è un marker precoce della degenerazione neurofibrillare nei pazienti con malattia di Alzheimer (Maurage et al., 2003). L’epitopo fosforilato serina 199 si trova anche in altre tauopatie come la paralisi sopranucleare progressiva (Wray et al., 2008). È interessante notare che i neuroni dei giovani individui hanno mostrato di esprimere la serina tau-epitopo fosforilata 199 come pubblicato nell’articolo “A paradoxical expression of serine 199 phosphorylated tau-epitope is found in the hippocampus of young individual” (Maurage et al. 2001), utilizzando l’anticorpo 4BioDX (Rif. 4BDX-1502).
Anti-phospo APP
Il metabolismo dell’APP porta alla produzione di peptidi beta-amiloidi che sono i componenti principali dei depositi di amiloide nella malattia di Alzheimer. I peptidi beta-amiloide (Ab) sono prodotti in seguito a scissioni sequenziali di APP da parte di proteasi (chiamate secretasi). L’elaborazione di APP da secretase produce i frammenti carbossi-terminali (CTF) tra cui i frammenti beta-carbossi-terminali substrati della gamma-secretasi per produrre peptidi beta-amiloide.
L’elaborazione dell’APP è regolata dalla fosforilazione citoplasmatica in diversi siti (Lee et al., 2003). La fosforilazione a Thr668 (una posizione corrispondente all’isoforma APP695) è uno dei principali siti di fosforilazione all’interno di APP.
APP-CTF fosforilati sono substrati della gamma-secretasi e un aumento della fosforilazione a Thr668 di APP-CTF facilita il loro trattamento con gamma-secretasi (Vingtdeux et al., 2005). La fosforilazione di APP a Thr668 da parte di JNK è necessaria per la scissione γ mediata del frammento C-terminale di APP prodotto dalla β-secretasi (Mazzitelli et al., 2011) e il meccanismo di fosforilazione a Thr-668 di frammenti APP C-terminal regola il localizzazione di APP, influenza la sua elaborazione da γ-secretasi e migliora la produzione di peptidi Abeta (Matsushima et al., 2012).
APP è fosforilata a Thr-668 sia in vitro che in vivo da un certo numero di chinasi comprendenti glicogeno sintasi chinasi 3β (GSK3β), Jun N-terminale chinasi-3 (JNK3), Jun N-terminale chinasi 1 (JNK1), divisione cellulare proteina del ciclo (Cdc2), chinasi ciclina-dipendente 5 (Cdk5) e DYRK1A (tirosina a doppia specificità (Y) – cinetica regolata dalla fosforilazione 1A) (Van der Kant e Goldstein, 2015). La fosforilazione di APP a Thr-668 è anche associata “all’estensione dei neuriti”, al trasporto anterogrado del carico vescicolare nei “neuriti”, al trasporto assonale e al “signaling” al nucleo (Vingtdeux et al., 2005; Chang et al., 2006).
Strutturalmente, la fosforilazione di APP a Thr-668 provoca un significativo cambiamento conformazionale che influenza le interazioni con i partner di legame e quindi influenza la localizzazione subcellulare e il metabolismo (Ramelot e Nickolson, 2001). Lo stato di fosforilazione di Thr-668 crea o distrugge i siti di docking per le proteine ​​intracellulari che interagiscono con APP.
Attraverso l’analogia con la proteina Notch, APP viene anche descritta come un recettore della superficie cellulare che segnala rilasciando un dominio intracellulare (AICD) al nucleo che, insieme a Fe65 e Tip60, regola quindi l’espressione genica (Cao e Sudhof 2001; Vingtdeux et al. 2005). La fosforilazione a Thr-668 fornisce FE65 che consente la traslocazione nucleare di AICD e l’attivazione genica che inducono la neurodegenerazione (Vingtdeux et al., 2005; Kimberly et al., 2005; Nakaya et al., 2006). Il residuo intracellulare Thr668 di APP è condizione per deficit di plasticità sinaptica e memoria (Lombino et al., 2013) e quando co-espresso con Fe65, la fosforilazione di APP-CTF a Thr-668 è risultata ridotta così come i depositi di amiloide in modelli di topi transgenici (Santiard-Baron et al., 2005).
L’anticorpo policlonale di coniglio pT668 (riferimento 4BDX-1503) riconosce la treonina fosforilata 668 del precursore proteico dell’amiloide (APP) ed è adatto per Western Blot, per immunoistochimica e immunofluorescenza.
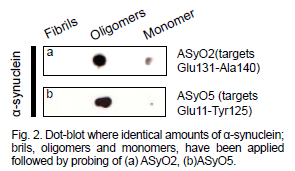
3. Parkinson
Anticorpi Agrisera Oligomer-specific alpha-synuclein (mouse):
-
Anticorpo monoclonale sviluppato in mouse
-
Isotipo IgG
-
Si lega agli oligomeri ma non alle fibrille di alfa-sinucleina umana (Fig. 2)
.
.
ASyO2 | Mouse anti-human alpha-synuclein | oligomer-specific (clone number 51.24) AGR-AS132717
ASyO2-biotinylated | Mouse anti-human alpha-synuclein | oligomer-specific AGR-AS132717B
ASyO5 | Mouse anti-human alpha-synuclein | oligomer-specific (clone number 2.4) AGR-AS132718
ASyO5-biotinylated | Mouse anti-human alpha-synuclein | oligomer-specific AGR-AS132718B
ASyM | Mouse anti-human alpha synuclein N-terminal (clone number 4.2) AGR-AS132719
ASyM-biotinylated | Mouse anti-human alpha synuclein N-terminal AGR-AS132719B
ELISA kit:
Per ulteriori informazioni CONTATTACI.


